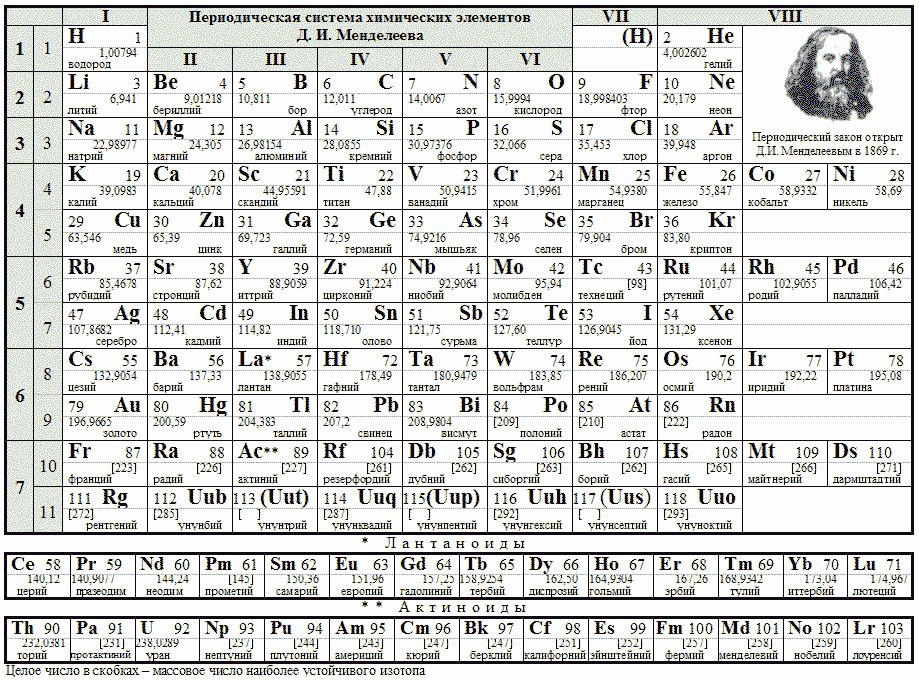
Bildquelle: https://www.sev-chem.narod.ru/spravochnik/mendeleev.jpg Quelle: [1] Larson, Dewey B., http://library.rstheory.org, Basic Properties of Matte, Chapter 24 "Isotopes."
Periodisches System: Die Eigenschaften der Elemente ändern sich mit steigender Ordnungszahl (Kernladungszahl) in durch die Elektronenkonfiguration vorgegebenen 'Perioden'. Das gilt für ihre physikalischen Eigenschaften, für die Art, wie sie Verbindungen mit anderen Elementen eingehen, und auch für die Eigenschaften analoger Verbindungen. Nur 91 der Elemente kommen natürlich vor, es werden immer weitere Elemente, z. B. 118 Moskowium, entdeckt. Diese spielen für das Bauwesen keine Rolle und werden daher auch nicht genannt.
Im Periodensystem der Elemente sind diese Elementgruppen grafisch dargestellt. In den Spalten findet man die Haupt- und Nebengruppen. Die Zeilen entsprechen den 'Perioden', das heißt, den Elektronenschalen, die mit wachsender Ordnungszahl aufgefüllt werden. Die Elemente lassen sich in Metalle und Nichtmetalle aufteilen. Zu den Nichtmetallen gehören auch der Wasserstoff und die Edelgase.
Wichtige Untergruppen sind: Edelgase: Gruppe 0; Alkalimetalle: Hauptgruppe 1 ohne den Wasserstoff); Erdalkalimetalle: Hauptgruppe 2 (ohne Be und Ra); Halogene: Hauptgruppe 7; Eisenmetalle (Fe, Ni, Co), leichte Platinmetalle (Ru; Rh, Pd) und schwere Platinmetalle (Os, Jr. Pt): Gruppe 8.
Im folgenden Periodensystem fehlen die nicht offiziell bekannten der 143 Elemente. A= Hauptgruppe, B= Nebengruppe
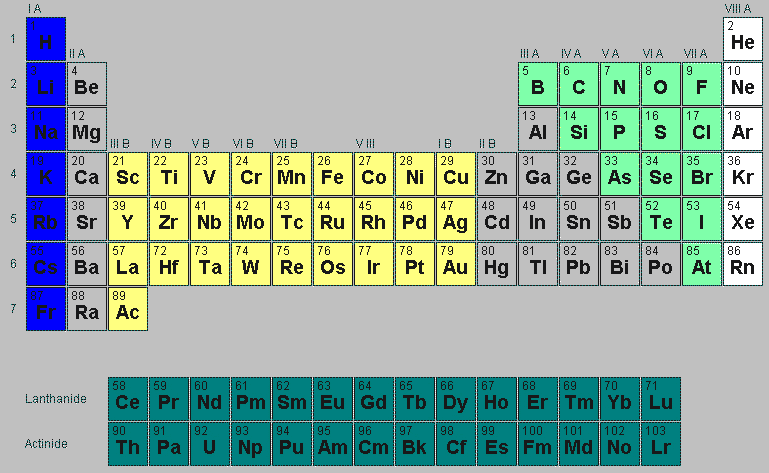
Im Bereich des Bauwesens kommen viel chemische Elemente und Verbindungen zur Anwendung. Zum Verständnis der bauchemischer Reaktionen (Abbindeprozesse), mögliche chemische Belastungen in den Wohnräumen, Nachweisreaktionen usw. sind Kenntnisse der Stoffeigenschaften erforderlich. Dieses Periodensystem dient als Ergänzung für die zahlreichen Fachartikel zur Bauchemie und Baubiologie auf dieser Webseite ib-rauch.de.
Im Bauwesen werden viele chemische Elemente verwendet. Im nachfolgenden Periodensystm sind die wichtigsten Elemente mit den Beschreibungen ihrer Eigenschaften verlinkt. 91 der Elemente kommen natürlich vor, es werden immer weitere Elemente, z. B. 118 Moskowium, entdeckt. Inoffiziell gibt es 143 Elemente im Periodensystem. Diese spielen für das Bauwesen keine Rolle und werden daher auch nicht genannt. (Boris Bolotov entdeckte 5000 Elemente.)
Larson stellt ein besseres Atommodell basierend auf der Physik des Reziproken Systems (RS) vor. Das Konzept geht von skalaren Bewegung aus. Die natürliche Konsequenz dieses Modells beruht darauf, dass für die Atome zwei "Zerstörungslimiten" existieren. Das sind ein Wärmelimit und ein Alterslimit. Das Alterslimit betrifft das Einfangen von geladenen Elektron-Neutrinos durch die Atome, welche isotopische Masse aufbauen. Das Wärmelimit tritt bei thermonuklearen Reaktionen auf. [1]
Weitere Informationen auch zum Periodensystem von Dmitri Iwanowitsch Mendelejew im Artikel Elemente im Periodensystem, die in Baustoffen vorkommen.
| Periode | I. Hauptgruppe Nebengruppe | VIII. Hauptgruppe Nebengruppe | ||||||||||||||||
1 | 1 1,008
H
|
II. Hauptgruppe Nebengruppe |
III. Hauptgruppe Nebengruppe |
IV. Hauptgruppe Nebengruppe |
V. Hauptgruppe Nebengruppe |
VI. Hauptgruppe Nebengruppe |
VII. Hauptgruppe Nebengruppe |
2 4,003
He
Helium |
||||||||||
2 | 3 6,94
Li
Lidium | 4 9,01
Be
Beryllium | 5 10,81
B
| 6 12,01
C
| 7 14,007
N
| 8 15,999
0
| 9 18,998
F
Fluor | 10 20,18
Ne
Neon |
||||||||||
3 | 11 22,989
Na
Natrium | 3 24,31
Mg
| 13 26,89
AL
| 14 28,09
Si
| 15 30,97
P
Phosphor | 16 32,06
S
| 17 35,45
Cl
| 18 39,95
Ar
Argon | ||||||||||
4 | 19 39,11
K
Kalium | 20 40,08
Ca
Kalzium | 21 44,96
Sc
Skandium |
22 47,90
Ti
|
23 50,94
V
|
24 51,996
Cr
|
22 54,94
Mn
|
26 55,85
Fe
|
27 58,93
Co
|
28 58,71
Ni
|
||||||||
29 63,54
Cu
|
30 65,37
Zn
|
31 69,72
Ga
Gallium | 32 72,59
Ge
Germanium | 33 74,92
As
| 34 78,96
Se
Selen | 35 79,91
Br
Brom | 36 83,80
Kr
Krypton | |||||||||||
5 | 37 85,47
Rb
Rubidium | 38 87,62
Sr
Strontium | 39 88,91
Y
Yttrium |
40 91,22
Zr
Zirkonium |
41 92,91
Nb
|
42 95,94
Mo
|
43 [99]
Tc
Technetium |
44 101,07
Ru
Ruthenium |
45 102,91
Rh
Rhodium |
46 106,4
Pd
Palladium | ||||||||
47 107,87
Ag
|
48 112,40
cd
Kadmium |
49 114,82
In
Indium | 50 118,69
Sn
| 51 121,75
Sb
| 52 127,60
Te
Tellur | 53 126,90
J
Jod | 54 131,30
Xe
Xenon | |||||||||||
6 | 55 132,91
Cs
Zäsium | 56 137,34
Ba
Barium | 57* 138,91
La
Lanthan |
72 178,49
Hf
Hafnium |
73 180,95
Ta
|
74 183,85
W
|
75 186,2
Re
Rhenium |
76 190,2
Os
Osmium |
77 192,2
Ir
Iridium |
78 195,09
Pt
Platin |
||||||||
79 196,97
Au
|
80 200,59
Hg
Quecksilber |
81 204,37
TI
Thallium | 82 207,19
Pb
| 83 208,98
Bi
Wismut | 84 209
Po
Polonium | 85 [210]
At
Astat | 86 [222]
Rn
Radon | |||||||||||
7 | 87 [223]
Fr
Franzium | 88 [226]
Fr
Radium | 89** [227]
Ac
Aktinium |
104 [261]
Ku
Kurtscha-tovium |
||||||||||||||
*Die Lanthanide und die **Aktinide werden hier nicht aufgeführt. Im Periodensystem werden sie mit aufgeführt. Erläuterung:
|
|
Периодическая система элементов Д.И. Менделеева

Bildquelle: https://www.sev-chem.narod.ru/spravochnik/mendeleev.jpg
Quelle: [1] Larson, Dewey B., http://library.rstheory.org, Basic Properties of Matte, Chapter 24 "Isotopes."

© Altbausanierung | Bauideen | gesund Leben | Impressum | AGB/Datenschutzerklärung | 1/2019 ![]()