Eigenschaften von Stickstoff (Nitrogen) und dessen chemische Verwendung
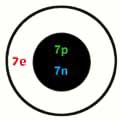 Stickstoff (Nitrogen) hat das Elementsymbol N mit der Ordnungszahl 7 (Periodensystem). Die Atommasse beträgt 14,0067, die Schmelztemperatur liegt bei -210ºC und die Siedetemperatur bei -196ºC. Die Wertigkeit +1 bis +5 und -3.
Stickstoff (Nitrogen) hat das Elementsymbol N mit der Ordnungszahl 7 (Periodensystem). Die Atommasse beträgt 14,0067, die Schmelztemperatur liegt bei -210ºC und die Siedetemperatur bei -196ºC. Die Wertigkeit +1 bis +5 und -3.
Vorkommen:
- frei als Hauptbestandteil der Luft der Erde 78,1 Vol.-% mit ca. 3x1015 Tonnen.
- anorganisch gebunden in Natronsalpeter NaN03, Kalisalpeter KN03 sowie im Ammoniak (Verwesung von Eiweißstoffen)
- organisch gebunden in allen Organismen der Erde (Eiweißstoffe, Nukleinsäuren und in den Stoffwechselendprodukten Harnstoff und Harnsäure) und in der Kohle. Siehe auch nitrose Gase.
Eigenschaften: Stickstoff ist farb-, geruch- und geschmackloses Gas, welches auch im flüssigen und festen Zustand farblos ist. Es ist sehr reaktionsträge und verbindet sich bei normaler Temperatur nur mit Lithium und bei höherer Temperatur auch mit Kalzium und Magnesium zu Nitriden. Technisch wird der Luftstickstoff genutzt über die Ammoniaksynthese nach Haber-Bosch (Bindung an Wasserstoff) und Kalkstickstoffsynthese nach Frank-Caro (Bindung an Kalziumkarbid).
Verwendung: Ausgangsstoff vieler chemische Verbindungen, Ammoniak und Salpetersäure, die als Grundstoffe für die Herstellung von Düngemittel, Explosivstoffe, Farbstoffe, Desinfektionsmittel, Polyester, Zelluloid, Schutzgas, Kühlmittel und vieles mehr dient.
Biologische Bedeutung: Nur wenige Bakterien vermögen den Luftstickstoff unmittelbar zu binden, alle anderen Organismen sind auf die Zufuhr von Stickstoffverbindungen angewiesen. Die Pflanzen entnehmen dem Boden Nitrate, Ammoniumverbindungen, die Tiere verwerten den organisch gebundenen Stickstoff bei der Nahrungsaufnahme, siehe auch Kreislauf des Stickstoff.
Bedeutung für das Bauwesen: Stickstoff ist Bestandteil vieler Kunststoffe und in Farben und dient als Schutzgas beim Schweißen. Es kommt aber auch als Salze im Mauerwerk, wie Magnesiumnitrat und Kalziumnitrat (echter Mauersalpeter) vor.
Die Nitratausblühungen sind relativ selten, meistens stammen die Ausblühungen von Karbonaten, Sulfaten oder auch Chloriden. Nitrate gelangen dann in das Mauerwerk, wenn Fäkalien, Mist, Kunstdünger oder andere nitrathaltige Stoffe am oder im Gebäude gelagert werden oder diese durch Regenwasser ausgespült und so über den Boden an das Gebäude gelangen können.
Z. B. ein Adventskranz mit vier Kerzen erzeugt mehr Stickoxid in Wohnräumen als nach den Straßengrenzwert zulässig ist, also mehr als tausende von Dieselfahrzeuge.
Quelle:
Schröter, Werner; Lautenschläger, Karl-Heinz; Chemie Fachbuchverlage Leipzig 17. Aufl. 1986, S.367ff
© Altbausanierung | Bauideen | gesund Leben | Impressum | AGB/Datenschutzerklärung | 1/2019 ![]()
