Eigenschaften und Verwendung von Schwefel
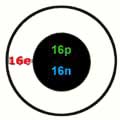 Schwefel (Sulfur) hat das Elementsymbol S. Ordnungszahl 16 (Periodensystem), die Atommasse beträgt 32,066, Schmelztemperatur 119ºC und Siedetemperatur 444ºC, Wertigkeit +6, +4, -2
Schwefel (Sulfur) hat das Elementsymbol S. Ordnungszahl 16 (Periodensystem), die Atommasse beträgt 32,066, Schmelztemperatur 119ºC und Siedetemperatur 444ºC, Wertigkeit +6, +4, -2
Vorkommen: teil frei, teils chemisch gebunden in Sulfiden und Sulfaten in Kohle, Erdöl und den Eiweißstoffen (besonders im Keratin der Haare, Federn und Häute). Schwefelwasserstoff kommt in Schwefelquellen, Vulkan- und Erdgasen und bei faulenden Eiweißstoffen vor.
Eigenschaften: Schwefel verbrennt beim Erhitzen an der Luft mit blauer Flamme zu Schwefeldioxid (SO2) und kleine Mengen Schwefeltrioxid (SO3). Bei höheren Temperaturen entstehen mit Metallen Sulfide. Für den Menschen ist Schwefel ungiftig. Siehe auch Kreislauf des Schwefels bei der Einwirkung von Mikroorganismen.
Verwendung: Zur Herstellung von Kohlendisulfid, Schwefelsäure, Schwefelfarbstoffe, zur Vulkanisation von Kautschuk, zur Herstellung von Schwarzpulver, gegen Hautkrankheiten, zur Bekämpfung von Schädlingen, zum Beispiel als Pflanzenschutzmittel "Schwefelkalkbrühe" gegen Rebenmehltau. Kleine Schwefelmengen wirken abführend und fein verteilt auf der Haut wirkt es bei Hautkrankheiten durch seine chemische Umwandlung.
Im Bauwesen kommt Schwefel im Bindemittel Gips und als Mauersalz CaSO4 vor. Sind die Ziegelsteine sehr saugfähig, so kann es bei Durchfeuchtungen des Ziegelrohbaus zu Sulfatausblühungen kommen.
Besonders leicht blüht Na2SO4 aus. Besonders gefährdet sind Schlagregenseiten. (Regenwasser hat ein sehr großes Lösungsvermögen, es ist CO2-haltig und frei von gelösten Salzen.)
Schwefeloxide in feuchten Staubablagerungen und Niederschläge gerade in Industriegebieten führten zu stärkeren Korrosionserscheinungen an Metall- und Bauwerkskonstruktionen. Durch gezielte Umweltmaßnahmen ist der Anteil an Schwefelverbindungen in der Luft zurückgegangen.
In vielen chemischen Produkten, Ascheablagerungen in Oberflächen-, Ab- und Meereswasser befinden sich Sulfate, deren Lösungen sehr tief in die Baustoffe eindringen und mit den Kalziumverbindungen des Zementsteins reagieren. Das Volumen des entstehenden Kalziumsulfats ist wesentlich größer und treiben somit das Betongefüge auseinander (treibende Korrosion).
MgSO4 + Ca(OH)2 + 2 H2O ---> CaSO4 . 2 H2O + Mg(OH)2
Das genannte Schwefeldioxid, welches in Verbrennungsgasen vorkommt, bildet mit Wasser eine Säure (H2S04 oder H2SO3). Diese Säure kommt in chemischen Produkten, in Abwässern und im Wasser vor. Die Säure bildet mit dem Kalziumhydroxid das zum Teil wasserlösliche und treibende Kalziumsulfat (Gips).
Ca(OH)2 + H2SO4 --> CaSO4 + 2 H2O
Quelle:
Schröter, Werner; Lautenschläger, Karl-Heinz; Chemie Fachbuchverlage Leipzig 17. Aufl. 1986, S.391ff
Scholz, Wilhelm; Baustoffkenntnis 13. Aufl., Werner Verlag 1995, S. 363
© Altbausanierung | Bauideen | gesund Leben | Impressum | AGB/Datenschutzerklärung | 1/2019 ![]()
